물이 얼음 위에 뜨는 현상은 물의 독특한 분자 구조와 **수소 결합(hydrogen bonding)**의 특성 때문에 발생합니다. 대부분의 물질은 고체 상태가 액체 상태보다 밀도가 높아 가라앉지만, 물은 예외적인 물질로 고체(얼음)가 액체보다 밀도가 낮아 물에 뜨게 됩니다.
- 물 분자의 구조 (H₂O):
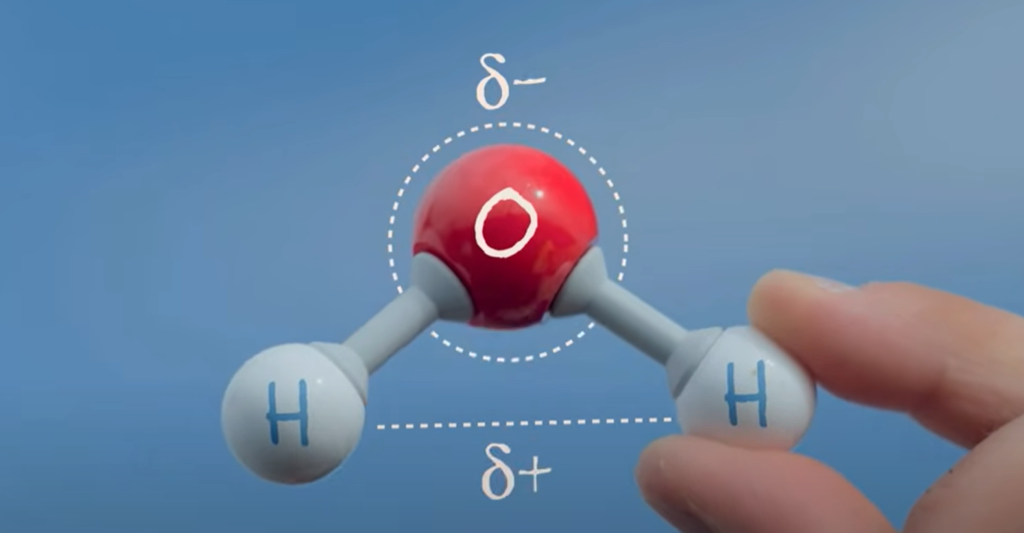
- 이 구조로 인해 물은 **극성 분자(polar molecule)**가 되어 산소 쪽은 약한 음전하(δ-), 수소 쪽은 약한 **양전하(δ+)**를 띱니다.
- 물 분자는 산소 원자 1개와 수소 원자 2개로 이루어져 있으며, 약 **104.5°**의 **굽은 형태(bent shape)**를 가집니다.
- 수소 결합 (Hydrogen Bonding):
- 물 분자의 극성은 분자 간에 수소 결합을 형성하게 만듭니다. 이는 한 물 분자의 수소 원자가 다른 물 분자의 산소 원자와 끌어당겨지는 현상입니다
- 액체 상태의 물에서는 분자들이 빠르게 움직이기 때문에 수소 결합이 계속해서 끊어졌다가 다시 형성됩니다.
- 물이 어는 과정 (Freezing Process):
- 물이 0°C (32°F)로 냉각되면 분자들의 운동 에너지(kinetic energy)가 감소합니다.
- 에너지가 줄어들면서 수소 결합이 더 안정적으로 유지되어, 분자들이 **육각형의 결정 구조(hexagonal crystalline lattice)**를 형성하게 됩니다.
- 이 구조는 분자들이 더 넓은 간격으로 배치되도록 만들어, 얼음 내부에 **빈 공간(open spaces)**이 생깁니다.
- 밀도와 부력 (Density and Buoyancy):
- **밀도(density)**는 질량 ÷ 부피로 정의됩니다. 물이 얼면:
- **부피(volume)**는 수소 결합 구조로 인해 늘어나고,
- **질량(mass)**은 변하지 않습니다.
- 부피가 증가하면서 밀도는 낮아지게 됩니다.
- 이로 인해 얼음은 액체 물보다 밀도가 낮아 물에 뜰 수 있습니다.
- **아르키메데스의 원리(Archimedes’ Principle)**에 따르면, 물체가 그 물질보다 밀도가 낮으면 물에 뜨고, 자기 무게와 같은 양의 물을 밀어내면서 부력을 받게 됩니다.
- **밀도(density)**는 질량 ÷ 부피로 정의됩니다. 물이 얼면:
- 얼음이 뜨는 것의 중요성:
- *환경적 영향: 얼음은 물 표면에 **단열층(insulating layer)**을 형성해, 아래의 물이 쉽게 얼지 않도록 보호합니다. 이는 겨울철 수생 생물의 생존에 매우 중요합니다.
- 독특한 성질: 만약 얼음이 물에 가라앉는다면, 호수와 바다의 얼음은 바닥부터 얼기 시작해 생태계에 큰 영향을 미쳤을 것입니다.
- *환경적 영향: 얼음은 물 표면에 **단열층(insulating layer)**을 형성해, 아래의 물이 쉽게 얼지 않도록 보호합니다. 이는 겨울철 수생 생물의 생존에 매우 중요합니다.
- 수치적 관점 (Quantitative Perspective):
- 액체 상태의 물 밀도: 약 1.0 g/cm³ (4°C에서 가장 밀도가 높음)얼음의 밀도: 약 0.917 g/cm³, 즉 액체 물보다 약 9% 더 가볍습니다.
- 이로 인해 얼음의 약 9% 정도가 물 위에 떠 있는 부분으로 남게 됩니다
요약 (Summary):
얼음이 물에 뜨는 이유는 수소 결합으로 형성된 결정 구조가 물이 얼 때 생기기 때문입니다. 이 구조는 같은 질량으로 더 많은 부피를 차지하게 만들어 밀도가 낮아지며, 이로 인해 얼음이 물에 뜹니다. 이러한 특성은 지구의 생태계 유지에 필수적인 요소이며, 물의 독특한 화학적 특성을 보여주는 놀라운 사례입니다.
The phenomenon of ice floating on water is a result of the unique molecular structure of water and the behavior of hydrogen bonds. This property is quite rare because, for most substances, the solid phase is denser than the liquid phase. However, water is an anomalous substance where the solid (ice) is less dense than its liquid form.
1. Molecular Structure of Water (H₂O):
- A water molecule consists of two hydrogen atoms bonded to an oxygen atom, forming a bent shape with an angle of about 104.5°.
- This shape causes water to be a polar molecule, where the oxygen has a slight negative charge (δ-) and the hydrogen atoms have a slight positive charge (δ+).
2. Hydrogen Bonding:
- The polarity of water molecules leads to the formation of hydrogen bonds, where the hydrogen atom of one molecule is attracted to the oxygen atom of another molecule.
- In liquid water, these hydrogen bonds are constantly breaking and reforming because the molecules are moving rapidly due to thermal energy.
3. The Freezing Process:
- As water cools down to 0°C (32°F), the kinetic energy of the molecules decreases.
- This slowdown allows the hydrogen bonds to become more stable and form a rigid, hexagonal crystalline lattice structure in ice.
- This lattice forces the molecules to be arranged in a way that maximizes the distance between them, creating open spaces within the structure.
4. Density and Buoyancy:
- Density is defined as mass per unit volume. When water freezes:
- The volume increases because of the open hexagonal lattice structure.
- The mass stays the same, but since the volume increases, the density decreases.
- This means that ice is less dense than liquid water, which is why it floats.
- According to Archimedes’ Principle, an object will float if it is less dense than the fluid it is placed in because it displaces an amount of fluid equal to its own weight before being fully submerged.
5. Importance of Ice Floating:
- Environmental Impact: Ice floating on the surface of bodies of water creates an insulating layer, which helps regulate the temperature of the water below. This is vital for the survival of aquatic life in cold climates.
- Unique Property: If ice sank, lakes and oceans would freeze from the bottom up, drastically altering ecosystems.
6. Quantitative Perspective:
- Density of liquid water: Approximately 1.0 g/cm³ at 4°C (where water is densest).
- Density of ice: About 0.917 g/cm³, which is ~9% less than that of liquid water.
- This difference causes about 9% of the ice’s volume to remain above the water’s surface when it floats.
Summary:
Ice floats because of the hydrogen-bonded crystalline structure that forms when water freezes. This structure increases the volume without increasing the mass, making ice less dense than liquid water. This property is crucial for maintaining life on Earth and is a remarkable example of water’s unique chemical behavior.